Science | “动动”密码子表,让“冷门”密码子编码非天然氨基酸
大自然的奇妙之一,在于它仅仅使用20种氨基酸“积木”就排列组合出千千万万种蛋白质,从而演绎出丰富多彩的生命图景。而科学家的好奇心不止于此:如果生命能调用20种以外的非天然氨基酸来制造蛋白质,会怎么样呢?
面对这一猜想,经血管植入器械全国重点实验室林圣贤研究院团队发明了“稀有密码子重编码技术”进行尝试。“简单地说,我们‘黑’进了哺乳动物细胞的蛋白质‘工厂’,使其能够高效编码非天然氨基酸,进而组装出全新的蛋白质分子。”林世贤说。研究论文Rare codon recoding for efficient noncanonical amino acid incorporation in mammalian cells(论文DOI: )6月7日发表于Science《科学》杂志。
这项突破引起了学术界的广泛关注,代表性的观点认为,这一技术为人们更加自由、更高效地设计蛋白质药物奠定了基础;同时,也为研究非天然氨基酸的生命机制提供了平台与工具。
一张“单词表”主宰了蛋白质翻译
细胞中组装蛋白质的“工厂”在核糖体,其中的生产过程被称为“蛋白质翻译”。它有点类似于人类的语言系统:携带遗传信息的mRNA(信使RNA)上排列的碱基像一个个“字母”,每3个碱基形成一个密码子“单词”,它们由tRNA(转运RNA)和合成酶“翻译”成氨基酸“单词”,一个个氨基酸连接起来就形成了蛋白质“句子”。
经过数十亿年的演化,地球上的几乎所有生物都“参照”同一张密码子表。从细菌到大象,从爬虫到人类, 表上的氨基酸“单词”就这固定的20种。我们知道,碱基一共有A、C、T、G四种,根据排列组合的规律,由3个碱基构成的密码子就有64种组合形式,它们中的61个对应编码了20种天然氨基酸同时有3个终止符(“句号”),翻译就是根据这张“单词表”进行的。
(图1:经典密码子表)
这张密码子表,将自然界的数百种氨基酸划分为天然氨基酸和非天然氨基酸。如果我们深入蛋白质“工厂”,可以看到我们每天通过食物摄入的氨基酸,如何井然有序地参与到生命活动:比如,谷氨酸等天然氨基酸有可能被细胞捕获进入翻译过程,组成蛋白质的一级结构;而非天然氨基酸则可能在翻译后“修饰”到蛋白质分子上,大大丰富了蛋白质的性质和功能。“蛋白质的多样性是生物功能多样性的基础。”林世贤说,人和小鼠在基因组规模上差别不大,但是人类的蛋白质的修饰和种类远比小鼠复杂,这可能是人类具有学习、思考、情感等更复杂功能与行为的原因。
“我们在想,能否在蛋白质翻译过程中就‘收编’非天然氨基酸,做仅靠20种天氨基酸做不了的事。”林世贤说,“在翻译阶段增加一点点化学复杂度,可能会产生海量的生物学可能性,带来新的性状和功能,我们可以据此创造新的功能型蛋白质……甚至生命形式。”
瞄准最“冷门”的密码子
怎么把“编外”氨基酸放到蛋白质主链上去呢?64个密码子承担了特定的翻译任务,“进化了数十亿年的翻译系统非常严密,‘工厂’的每个人都有确定的工作,你很难让它干点别的。”当林世贤像黑客一样打量这张密码子表时,他有了不一样的想法:“找一处新的漏洞‘黑’进去。”
(图2:能否提供一张图片,表现下文“TCG对应编码丝氨酸,在编码丝氨酸的6种密码子中,它是最冷门的一个——同样是编码丝氨酸的AGC,它出现的频率是TCG的5倍。”)
密码子表上,TCG对应编码丝氨酸,在编码丝氨酸的6种密码子中,它是最冷门的一个——同样是编码丝氨酸的AGC,它出现的频率是TCG的5倍。对于TCG这样在翻译系统中出现频率很低的密码子,人们称为稀有密码子,而在在林世贤的眼中,稀有密码子TCG可以作为“黑”入蛋白质翻译系统的 “软肋”。他的设想是:“让‘闲置’的密码子发挥点其他作用,在严密的‘工厂’内干点‘私活’!”
林世贤称这一方案为“稀有密码子重编码技术”(英文:Rare Codon Recoding),让稀有密码子去关联另外一个“单词”——非天然氨基酸。在古代,“槑”字作为“梅”的异体字并不常见;而如今的“槑”是一个网络热词,人们赋予了它“呆傻天真”的新含义。“多义词”的类比可以帮助理解林世贤的想法。让原本在翻译过程中很少“露面”的密码子,翻译出人们需要的“单词”。
本世纪初,美国化学生物学家Peter Schultz提出“基因密码子拓展技术”(英文:Genetic Code Expansion),他瞄准的是翻译系统的另一个“漏洞”——空白密码子,也就是用表示 “停止符”的密码子来引入非天然氨基酸。“稀有密码子从一开始就被排除在外,而我们证明了它的可行性。”林世贤说,“空白密码子在翻译过程中仍然有很大概率的终止,这样会让翻译效率大打折扣;而‘押注’在稀有密码子上或许更为稳定、有效。”
“收编”非天然氨基酸
林世贤介绍了 “黑客”系统的布设情况:首先通过遗传手段,让细胞内源性产生重编码tRNA和与之协同的合成酶,它们的任务是结合并催化转化外源非天然氨基酸;然后,在细胞的外部环境中加入“待入编”的非天然氨基酸。(图3)
林世贤说,核糖体是一个开放的系统,成千上万的氨基酸在等待被tRNA和合成酶识别后编码,这时要确保当核糖体遇到TCG这一密码子时,非天然氨基酸的竞争力要超过丝氨酸,“在质量和数量上都要占优势。”为此,研究人员通过大数据模型预测和系统工程改造,得到了高质量的重编码tRNA和合成酶;而数量的优势则通过大量添加外源的非天然氨基酸达成。
经过“里应外合”式的引导,TCG更倾向于编码非天然氨基酸,而非丝氨酸。并且,让非天然氨基酸可以在翻译过程中进入蛋白质的一级结构的任意位置。在这项研究中,曾经的“冷门”密码子表现出令人惊叹的效率,对于大多数测试的模型和功能蛋白质,其编码非天然氨基酸的效率达到80-90%,接近于天然氨基酸。此外,这一技术还强调了过程的“正交性”,也就是说,“这种操作绕过了翻译系统自带的纠错机制,以一种悄无声息的方式进入,并不会引起整个翻译系统的混乱。”林世贤说。
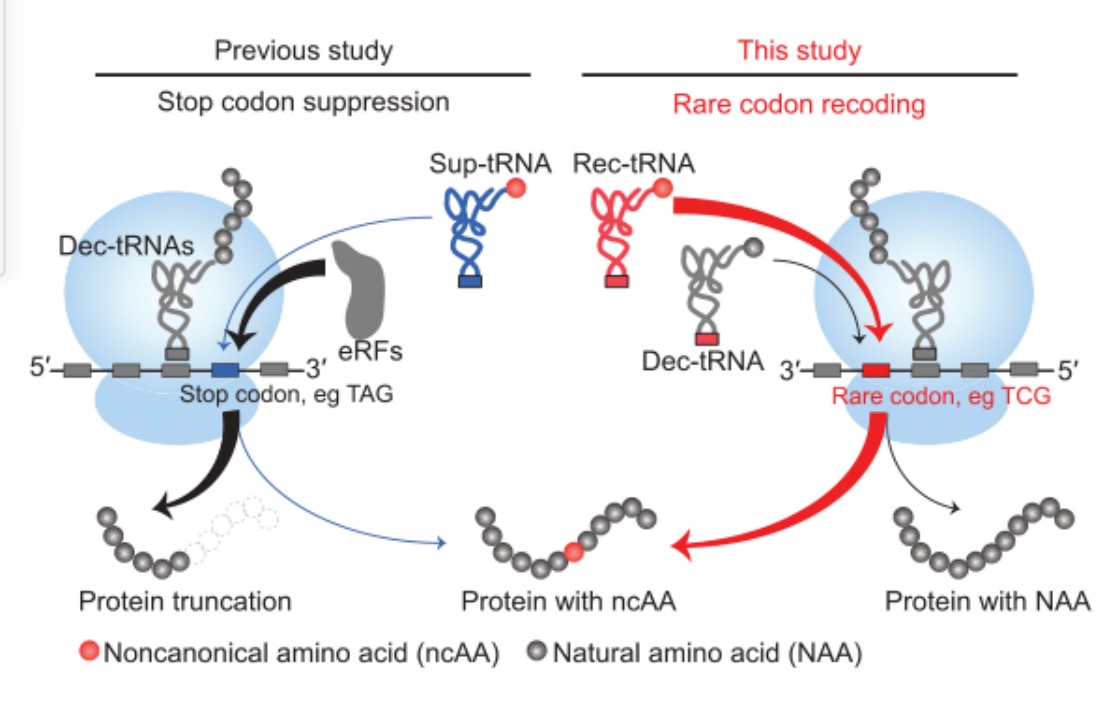
“稀有密码子重编码技术”(RCR)与“基因密码子拓展技术”(GCE)的原理差异图。
稀有密码子重编码技术让“冷门”密码子得以为人所用,担任编码非天然氨基酸的“重任”。“‘漏洞’、‘接口’和‘软件’都是我们发现和设计的。”林世贤对他设计的“黑客”系统感到自豪。在论文中,研究人员展示了在哺乳动物细胞中编码含有6个非天然氨基酸的蛋白质,或者编码4种不同非天然氨基酸的蛋白质,并且,编码的位置可以精确地设定。
蛋白质设计迎来“爆点”?
“设计药物、研究机理、探索新的生命形式。”谈及稀有密码子重编码技术的应用场景,林世贤不假思索地回答。这和他所在的 “化学生物学(Chemical Biology)”领域的学科特点有关,“我们更关心怎样让生命系统产出有价值的新物质和材料。这个领域最顶尖的科学家都做出过重要基础发现或新药研发。”例如2022年的诺贝尔奖获得者Carolyn R. Bertozzi,就提出用生物体的正交反应来开展生物机制研究和药物研发。
当非天然氨基酸可以高效地进入蛋白质一级结构,这意味着我们在设计蛋白质分子时获得了一个崭新的维度。让我们可以更加自由地引入特定功能的氨基酸,设计更多的非天然氨基酸药物。“这是我未来几年最感兴趣的方向。”林世贤说,“我们或许可以把一些蛋白质的功能推到极致。”据介绍,这一领域目前还处于起步阶段,FDA批准通过的带有非天然氨基酸的药物寥寥无几,并且都是通过化学合成而非生物合成的方法获得的。
同时,该项技术还为研究蛋白质修饰提供新的“生物元件”和工具。林世贤说,蛋白质的性质和功能不仅取决于其结构,还和蛋白质主链上的各种“修饰”分子有关。截止目前,人们已经发现的蛋白质功能修饰就有300多种。“很多修饰都是可以靠非天然氨基酸引入的。”林世贤说,所以该项技术也能依托非天然氨基酸这个“元件”,来引入和表达更多修饰,从而进一步研究修饰的生物学功能和调控机制。
更为久远的,就是探索新的生命形式。从生命演化的角度看,密码子表上并不是一开始就稳定在20种天然氨基酸,而是陆陆续续发展并稳定在20种的。它们曾经也可能是非天然氨基酸,经过一系列随机和选择事件,最终从“在野”成为“在编”。“我们也可以大胆想象,非天然氨基酸能促成新的生命形式,比如,一种特别抗冻的细胞?一种特别长寿的细胞?”当然,这还是一件比较遥远的事。
生命科学研究院的丁文龙博士、于微同学和陈宇霖博士是论文的共同第一作者,林世贤研究员是论文的通讯作者。该研究得到了科技部,国家自然科学基金委,经血管植入器械全国重点实验室开放课题,浙江大学启真项目,生物医学峰基金等项目的支持。